こんにちは!個別指導SUNSです。
みなさん、夏休みの勉強は捗っていますか?
受験生は入試に向けてこれまでの復習と、2学期のテストに向けた定期テスト対策で大変かと思いますが、毎日コツコツ頑張りましょう!
SUNSの生徒も毎日のように自習にくる子もいて、2学期のテストも入試も楽しみになってきました。良い結果が出るといいですね!
さて、今回は、中学3年生理科において、
2学期の試験に向けて、多くの人が苦戦する「化学変化と電池」について説明していこうと思います。
化学分野は電池だけにも関わらず、原子・分子やイオン、化学反応式、酸・アルカリなどみんなが苦労する範囲です。
1学期で化学分野がすべて終わったしまった人もいるかと思いますが、近隣の葛西第三中や東葛西中含めて、これから2学期中間テストで電池が試験範囲の学校も多いので、
電池とはどういう仕組みなのか、化学変化がどうかかわってくるのか説明していきたいと思います。
「化学変化と電池」どうして苦手?
先ほど化学分野はみんな苦労するといいましたが、なぜだと思いますか?
おそらく多くの人があまり苦手としない天体や生物分野と、
苦手とする人が多い化学や物理分野の、大きな違いはイメージがつきにくいからだと思います。
植物や昆虫、星や月など意識的ではないけど日常的に目に見えるものには抵抗感は感じにくい。
一方で、物体に働いている力や原子・分子・イオンなど目に見えないものには抵抗感が出やすいのだと思います。
そこに数学的な思考や、暗記項目も多く加わるので、物理や化学というのは苦戦する人が多い傾向にあります。
そのような場合は、仕組み・原理をしっかり理解するしかありません。
むしろ、その現象が起きるまでの道筋を理解していれば中学生理科は問題なくこなせます。
今回は中学理科の化学の中でも、仕組みを理解するのが難しい?電池について詳細を説明していきます。
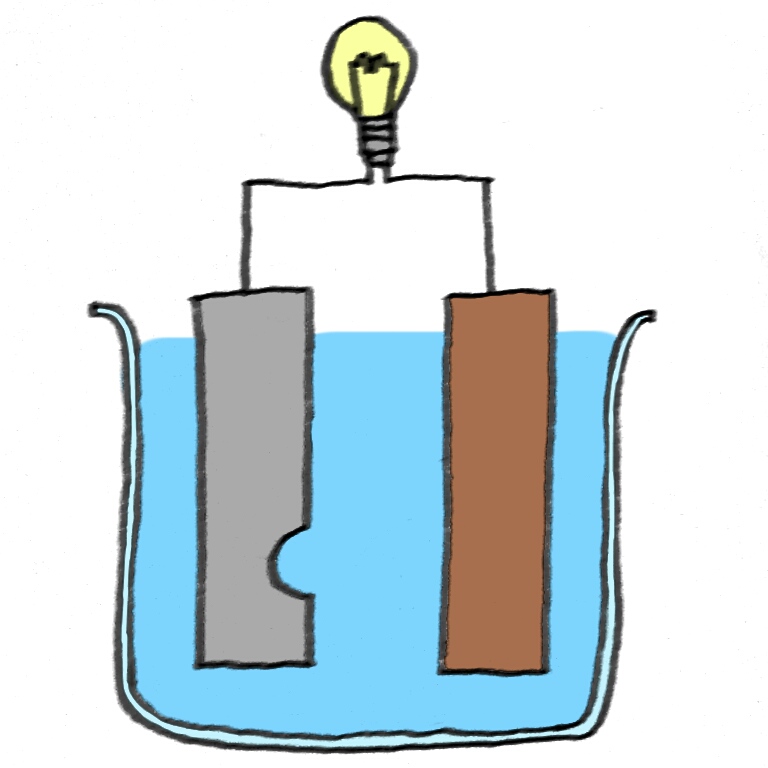
「ダニエル電池」

上のモデル図は、教科書にも載っていますが、ダニエル電池のモデル図です。
まずどこからどんな現象が始まるかを考えましょう。
みなさん、イオン化傾向という言葉は覚えてますか?
イオン化傾向とは、陽イオンへのなりやすさ(=溶けやすさ)であり、Zn>Cuです。
すなわち、上図のように亜鉛Znと銅Cuがあったときに、亜鉛が優先的に溶けます。
(イオン化傾向が覚えにくい方は、有名な語呂合わせがあります。「イオン化傾向 語呂合わせ」で検索してみてください。)
まず、亜鉛Znが硫酸亜鉛水溶液にとけます。溶けるということはイオンになることと同じなので、
亜鉛板では、Zn→Zn2++2e– という反応が起きます。(ー極)
亜鉛が陽イオンになるということは、亜鉛中の電子(e–)が外に放出されます。
発生した電子が導線を通って、銅板に移動します。
銅板では、移動してきた電子と硫酸銅水溶液中の銅イオンがくっつく反応が起きます。(+極)
Cu2++2e–→Cu
この反応によって、銅板上に銅が付着するため、赤色になります。
これがダニエル電池内で起きてる反応の一連の流れです。
さて、電池ですから電流が流れていますよね?
電流というのは「電子の流れ」です。先ほど亜鉛版から発生した電子が銅板に移動しましたよね。
それが電流の正体です。(電子と電流の向きは逆になるので注意!!)
ダニエル電池で電流が流れる仕組みわかりましたか?
大事なポイントは、イオン化傾向です。
おそらくイオン化傾向=陽イオンへのなりやすさだよ、としか教わらないところもあるかと思いますが、イオン化傾向があるからまず片方の金属が溶け始めて(イオンになって)、この原理がスタートします。もう一回全体の流れをおさらいします。
1.-極(亜鉛板)での反応 Zn→Zn2++2e–
↓
2.電子の流れ 亜鉛板→銅板へ電子が移動し、これが電流です。(電子と電流の流れは逆!)
↓
3.+極(銅板)での反応 Cu2++2e–→Cu
では、これを踏まえていくつか定期テストに出そうな例題を解いていきましょう!
(1)硫酸亜鉛水溶液、硫酸銅水溶液それぞれの濃度はどのように変化しますか?
A.硫酸亜鉛水溶液の濃度は、亜鉛イオンが増えるので、大きくなります!一方で、銅イオンは銅になるため、硫酸銅水溶液の濃度は小さくなります。
(2)亜鉛板、銅板で起こっている反応は?
亜鉛板:Zn→Zn2++2e–
銅板:Cu2++2e–→Cu
(3)塩酸に亜鉛板とマグネシウム板をいれた電池では、+極になるのはどちらの金属でしょうか。
これはイオン化傾向の問題です。
先ほど、ダニエル電池ではイオン化傾向が小さい銅板が+極になっていました。
今回の場合、亜鉛とマグネシウムでは、マグネシウムのほうがイオン化傾向が大きいため、
マグネシウムが-極、亜鉛が+極になります。

電池の説明は以上になります。
理解できましたでしょうか。
各板で起きる反応や、イオン化傾向との関係など理解していれば、どんな類題も理解できると思います。お持ちの問題集でぜひ解いてみてください。
では、残りの夏休み期間の勉強も頑張りましょう!!